Quá trình đẳng nhiệt - Nội dung định luật Bôi-lơ Ma-ri-ốt

Trạng thái và quá trình biến đổi trạng thái của chất khí
Trên thực tế, trạng thái của một chất khí sẽ được xác định thông qua các đại lượng sau đây:
- Áp suất (p), đơn vị đo là N/m², Pa, atm, mmHg…
- Thể tích (V), đơn vị đo là l hoặc m³
- Nhiệt độ tuyệt đối (T), đơn vị đo là độ C và được tính theo công thức T = 273 + t (với t là nhiệt độ Xen-xi-út).
Trên đây là các thông số chính của trang thái chất khí, giữa các thông số này thường có những mối liên hệ xác định.
Trong tự nhiên, 3 thông số này sẽ thay đổi liên tục, nếu như một trong các chỉ số thay đổi thì trạng thái khí cũng thay đổi theo. Quá trình này được gọi là quá trình biến đổi trạng thái khí. Và nếu như trong trường hợp có 2 thông số biến đổi còn một thông số được giữa nguyên thì đó được gọi là quá trình đẳng nhiệt.

Quá trình đẳng nhiệt là gì?
Quá trình đẳng nhiệt tên anh gọi là Isothermal Process được hiểu là quá trình biến đổi trạng thái của chất khí trong điều kiện nhiệt độ không thay đổi.
Một ví dụ cho quá trình đẳng nhiệt đó là: Một ống xilanh có chứa không khí ở áp suất và nhiệt độ thấp. Nếu bạn dùng tay nén từ từ piston để làm giảm thể tích. Khi đó áp suất khí cũng sẽ thay đổi. Ta gọi đây là quá trình đẳng nhiệt.
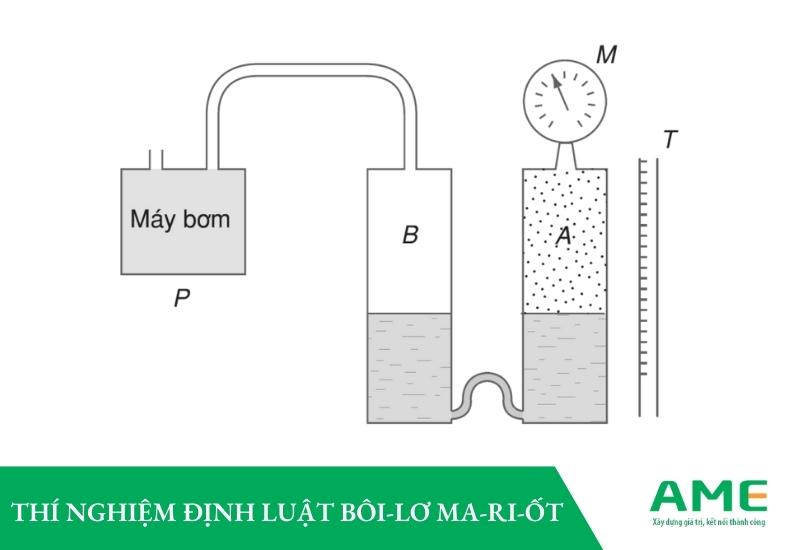
Khi thực hiện thí nghiệm thay đổi thể tích của một lượng khí, đo áp suất tương ứng với mỗi thể tích, ta sẽ được kết quả như sau:
| Thể tích V (cm3) | Áp suất P (105 Pa) | pV |
| 20 | 1.00 | 2 |
| 10 | 2.00 | 2 |
| 40 | 0.5 | 2 |
| 30 | 0.67 | 2 |
Từ thí nghiệm trên, ta có thể thấy được, trong quá trình đẳng nhiệt của một khí thì áp suất sẽ tỉ lệ thuận với thể tích.
Định luật Bôi-lơ Ma-ri-ốt
Dưới đây là nội dung của định luật Bôi-lơ Ma-ri-ốt, mời các bạn cùng theo dõi:
Phát biểu định luật
Trong quá trình đẳng nhiệt của một lượng khí nhất định thì áp suất (p) sẽ tỉ lệ nghịch với thể tích (V).
Định luật được khởi xướng vào năm 1662 bởi một Nhà vật lý thiên tài người Anh Bôi-lơ (1627 – 1691). Và nhà vật lý người Pháp Ma-ri-ốt (1620 – 1684) cùng tìm ra định luật tương tự vào năm 1676 nên nó được gọi là Bôi-lơ Ma-ri-ốt.
Công thức đẳng nhiệt
Từ định luật trên, ta có công thức đẳng nhiệt như sau:
pV = const (hằng số) hay p ~ 1V
Trong đó:
- p là áp suất (pa)
- V là thể tích (cm3)
Nếu gọi p1, V1 lần lượt là áp suất và thể tích của một lượng khí ở trong trạng thái p1 và p2, v2 là áp suất và thể tích của lượng khí ở trạng thái 2.
Theo như định luật Bôi-lơ Ma-ri-ốt ta có:
p1V1 = p2V2
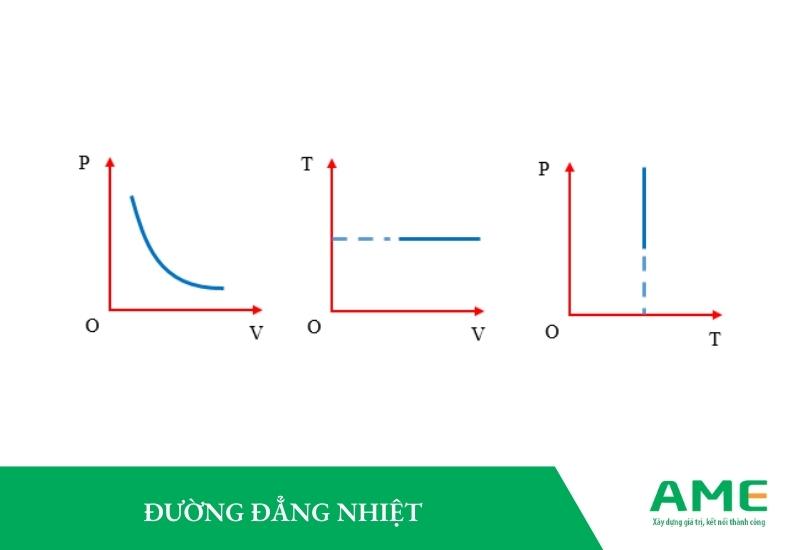
Đường đẳng nhiệt
Đường đẳng nhiệt được dùng để biểu diễn sự biến thiên của áp suất một lượng khí theo thể tích.
Trong hệ tọa độ (pOV) thì đường đẳng nhiệt là một đường cong hypebol. Nếu như nó nằm ở trên sẽ ứng với nhiệt độ cao so với đường đẳng nhiệt ở phía dưới.
Như vậy qua bài biết trên, chúng tôi đã chia sẻ đến bạn những thông tin liên quan đến quá trình đẳng nhiệt. Mong rằng nó sẽ giúp ích cho bạn trong quá trình tìm hiểu các vấn đề tương tự. Mọi thắc mắc hay những đóng góp ý kiến vui lòng liên hệ với AME Group để được hỗ trợ.
 Tiếng Việt
Tiếng Việt